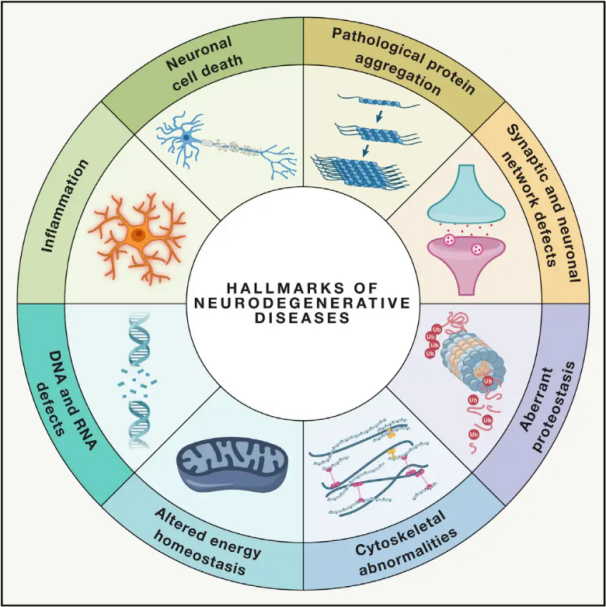
Neurodegenerative ErkrankungenNeurodegenerationen (NDDs) sind durch den fortschreitenden oder anhaltenden Verlust spezifischer, vulnerabler neuronaler Populationen im Gehirn oder Rückenmark gekennzeichnet. Die Klassifizierung von NDDs kann auf verschiedenen Kriterien basieren, darunter die anatomische Verteilung der Neurodegeneration (wie extrapyramidale Störungen, frontotemporale Demenz oder spinozerebelläre Ataxien), primäre molekulare Anomalien (wie Amyloid-β, Prionen, Tau oder α-Synuclein) oder wichtige klinische Merkmale (wie Morbus Parkinson, amyotrophe Lateralsklerose und Demenz). Trotz dieser Unterschiede in Klassifizierung und Symptomatik weisen Erkrankungen wie Morbus Parkinson (PD), Amyotrophe Lateralsklerose (ALS) und Alzheimer (AD) gemeinsame zugrunde liegende Prozesse auf, die zu neuronalen Funktionsstörungen und schließlich zum Zelltod führen.
Da weltweit Millionen Menschen von neurodegenerativen Erkrankungen betroffen sind, schätzt die Weltgesundheitsorganisation (WHO), dass diese Krankheiten bis 2040 die zweithäufigste Todesursache in den Industrieländern sein werden. Obwohl verschiedene Behandlungen zur Linderung und Behandlung der Symptome bestimmter Erkrankungen zur Verfügung stehen, sind wirksame Methoden zur Verlangsamung oder Heilung des Krankheitsverlaufs weiterhin schwer zu finden. Jüngste Studien deuten auf einen Paradigmenwechsel in der Behandlung hin: von der rein symptomatischen Therapie hin zur Nutzung zellschützender Mechanismen, um ein weiteres Fortschreiten der Erkrankung zu verhindern. Umfangreiche Erkenntnisse legen nahe, dass oxidativer Stress und Entzündungen eine zentrale Rolle bei der Neurodegeneration spielen und somit wichtige Angriffspunkte für den Zellschutz darstellen. In den letzten Jahren hat die Grundlagenforschung und klinische Forschung das Potenzial der hyperbaren Sauerstofftherapie (HBO) in der Behandlung neurodegenerativer Erkrankungen aufgezeigt.
Hyperbare Sauerstofftherapie (HBOT) verstehen
Die hyperbare Sauerstofftherapie (HBOT) beinhaltet typischerweise eine Erhöhung des Drucks auf über 1 Atmosphäre (ATA) – den Druck auf Meereshöhe – für eine Dauer von 90 bis 120 Minuten. Je nach zu behandelnder Erkrankung sind oft mehrere Sitzungen erforderlich. Der erhöhte Luftdruck verbessert die Sauerstoffversorgung der Zellen, was wiederum die Stammzellproliferation anregt und die durch bestimmte Wachstumsfaktoren vermittelten Heilungsprozesse fördert.
Ursprünglich basierte die Anwendung der hyperbaren Sauerstofftherapie (HBOT) auf dem Boyle-Marriott-Gesetz, das die druckabhängige Reduktion von Gasblasen und die Vorteile eines hohen Sauerstoffgehalts im Gewebe beschreibt. Zahlreiche Erkrankungen profitieren bekanntermaßen vom hyperoxischen Zustand, der durch HBOT erzeugt wird, darunter nekrotisches Gewebe, Strahlenschäden, Traumata, Verbrennungen, Kompartmentsyndrom und Gasbrand (siehe auch die Liste der Undersea and Hyperbaric Medical Society). HBOT hat sich zudem als adjuvante Therapie bei verschiedenen entzündlichen und infektiösen Erkrankungen wie Colitis und Sepsis als wirksam erwiesen. Aufgrund ihrer entzündungshemmenden und antioxidativen Mechanismen bietet HBOT ein erhebliches therapeutisches Potenzial für neurodegenerative Erkrankungen.
Präklinische Studien zur hyperbaren Sauerstofftherapie bei neurodegenerativen Erkrankungen: Erkenntnisse aus dem 3×Tg-Mausmodell
Eine der bemerkenswerten StudienIm Fokus stand das 3×Tg-Mausmodell der Alzheimer-Krankheit (AD), das das therapeutische Potenzial der hyperbaren Sauerstofftherapie (HBOT) zur Linderung kognitiver Defizite aufzeigte. Die Studie umfasste 17 Monate alte männliche 3×Tg-Mäuse im Vergleich zu 14 Monate alten männlichen C57BL/6-Mäusen als Kontrollgruppe. Die Ergebnisse zeigten, dass HBOT nicht nur die kognitive Funktion verbesserte, sondern auch Entzündungen, die Plaquebelastung und die Tau-Phosphorylierung – einen entscheidenden Prozess im Zusammenhang mit der AD-Pathologie – signifikant reduzierte.
Die protektiven Effekte der hyperbaren Sauerstofftherapie (HBOT) wurden auf eine Reduktion der Neuroinflammation zurückgeführt. Dies zeigte sich in der verminderten Proliferation von Mikroglia, der Astrogliose und der Sekretion proinflammatorischer Zytokine. Diese Ergebnisse unterstreichen die doppelte Rolle der HBOT: Sie verbessert die kognitive Leistungsfähigkeit und mildert gleichzeitig neuroinflammatorische Prozesse, die mit der Alzheimer-Krankheit einhergehen.
In einem weiteren präklinischen Modell wurden MPTP-Mäuse (Methyl-4-phenyl-1,2,3,6-tetrahydropyridin) eingesetzt, um die Schutzmechanismen der hyperbaren Sauerstofftherapie (HBOT) auf die neuronale Funktion und die motorischen Fähigkeiten zu untersuchen. Die Ergebnisse zeigten, dass HBOT bei diesen Mäusen zu einer verbesserten motorischen Aktivität und Greifkraft beitrug, was mit einer Steigerung der mitochondrialen Biogenese-Signalgebung, insbesondere durch die Aktivierung von SIRT-1, PGC-1α und TFAM, korrelierte. Dies unterstreicht die bedeutende Rolle der Mitochondrienfunktion für die neuroprotektiven Effekte der HBOT.
Die Wirkmechanismen der hyperbaren Sauerstofftherapie bei neurodegenerativen Erkrankungen
Das Grundprinzip der hyperbaren Sauerstofftherapie (HBOT) bei neurodegenerativen Erkrankungen (NDDs) beruht auf dem Zusammenhang zwischen verminderter Sauerstoffversorgung und der Anfälligkeit für neurodegenerative Veränderungen. Der Hypoxie-induzierbare Faktor-1 (HIF-1) spielt als Transkriptionsfaktor eine zentrale Rolle, da er die zelluläre Anpassung an niedrigen Sauerstoffpartialdruck ermöglicht und bei verschiedenen NDDs wie Alzheimer, Parkinson, Chorea Huntington und ALS eine Rolle spielt. Dies macht ihn zu einem wichtigen Zielmolekül für die medikamentöse Therapie.
Da das Alter ein signifikanter Risikofaktor für zahlreiche neurodegenerative Erkrankungen ist, ist die Untersuchung der Auswirkungen der hyperbaren Sauerstofftherapie (HBOT) auf die Neurobiologie des Alterns von entscheidender Bedeutung. Studien haben gezeigt, dass die hyperbare Sauerstofftherapie (HBOT) altersbedingte kognitive Defizite bei gesunden älteren Menschen verbessern kann.Darüber hinaus zeigten ältere Patienten mit erheblichen Gedächtnisstörungen nach der HBOT-Behandlung kognitive Verbesserungen und eine erhöhte Hirndurchblutung.
1. Einfluss der hyperbaren Sauerstofftherapie auf Entzündungen und oxidativen Stress
Die hyperbare Sauerstofftherapie (HBOT) hat sich als wirksam bei der Linderung von Neuroinflammationen bei Patienten mit schwerer Hirnfunktionsstörung erwiesen. Sie kann proinflammatorische Zytokine (wie IL-1β, IL-12, TNFα und IFNγ) herunterregulieren und gleichzeitig antiinflammatorische Zytokine (wie IL-10) hochregulieren. Einige Forscher vermuten, dass die durch die HBOT erzeugten reaktiven Sauerstoffspezies (ROS) mehrere positive Effekte der Therapie vermitteln. Demnach hängen die positiven Ergebnisse der HBOT – neben ihrer druckabhängigen, blasenreduzierenden Wirkung und der Erreichung einer hohen Sauerstoffsättigung im Gewebe – teilweise von den physiologischen Funktionen der produzierten ROS ab.
2. Auswirkungen der hyperbaren Sauerstofftherapie auf Apoptose und Neuroprotektion
Forschungen haben gezeigt, dass die hyperbare Sauerstofftherapie (HBOT) die Phosphorylierung der p38-Mitogen-aktivierten Proteinkinase (MAPK) im Hippocampus reduzieren und dadurch die Kognition verbessern sowie Hippocampusschäden mindern kann. Sowohl die alleinige Anwendung von HBOT als auch die Kombination mit Ginkgo-biloba-Extrakt senkten die Expression von Bax und die Aktivität von Caspase-9/3, was in Nagetiermodellen, die durch aβ25-35 induziert wurden, zu einer verringerten Apoptoserate führte. Eine weitere Studie zeigte zudem, dass eine HBOT-Präkonditionierung eine Toleranz gegenüber zerebraler Ischämie induzierte. Die zugrundeliegenden Mechanismen umfassen eine erhöhte SIRT1-Expression, einen Anstieg des B-Zell-Lymphom-2-Spiegels (Bcl-2) und eine Reduktion der aktiven Caspase-3, was die neuroprotektiven und antiapoptotischen Eigenschaften der HBOT unterstreicht.
3. Einfluss der HBOT auf den Kreislauf undNeurogenese
Die Anwendung von HBOT wurde mit vielfältigen Effekten auf das kraniale Gefäßsystem in Verbindung gebracht, darunter die Verbesserung der Durchlässigkeit der Blut-Hirn-Schranke, die Förderung der Angiogenese und die Reduzierung von Ödemen. Zusätzlich zur erhöhten Sauerstoffversorgung des Gewebes bewirkt HBOTfördert die Gefäßbildungdurch Aktivierung von Transkriptionsfaktoren wie dem vaskulären endothelialen Wachstumsfaktor und durch Anregung der Proliferation neuronaler Stammzellen.
4. Epigenetische Effekte der HBOT
Studien haben gezeigt, dass die Exposition menschlicher mikrovaskulärer Endothelzellen (HMEC-1) gegenüber hyperbarem Sauerstoff 8.101 Gene signifikant reguliert, darunter sowohl hoch- als auch herunterregulierte Expressionen, was auf eine Zunahme der Genexpression im Zusammenhang mit antioxidativen Reaktionswegen hinweist.
Abschluss
Die Anwendung der hyperbaren Sauerstofftherapie (HBOT) hat im Laufe der Zeit bedeutende Fortschritte gemacht und ihre Verfügbarkeit, Zuverlässigkeit und Sicherheit in der klinischen Praxis unter Beweis gestellt. Obwohl HBOT als Off-Label-Behandlung für neurodegenerative Erkrankungen erforscht wurde und bereits einige Studien dazu durchgeführt wurden, besteht weiterhin ein dringender Bedarf an strengen Studien zur Standardisierung der HBOT-Praxis bei der Behandlung dieser Erkrankungen. Weitere Forschung ist unerlässlich, um die optimale Behandlungsfrequenz zu bestimmen und das Ausmaß der positiven Effekte für die Patienten zu bewerten.
Zusammenfassend lässt sich sagen, dass die Schnittstelle zwischen hyperbarer Sauerstofftherapie und neurodegenerativen Erkrankungen ein vielversprechendes Feld therapeutischer Möglichkeiten darstellt, das weitere Erforschung und Validierung in klinischen Studien rechtfertigt.
Veröffentlichungsdatum: 16. Mai 2025

