Im Bereich der modernen Medizin haben sich Antibiotika als einer der bedeutendsten Fortschritte erwiesen und die Häufigkeit und Sterblichkeitsrate mikrobieller Infektionen drastisch gesenkt. Ihre Fähigkeit, den klinischen Verlauf bakterieller Infektionen zu beeinflussen, hat die Lebenserwartung unzähliger Patienten verlängert. Antibiotika sind bei komplexen medizinischen Eingriffen wie Operationen, Implantationen, Transplantationen und Chemotherapien unerlässlich. Die Zunahme antibiotikaresistenter Erreger ist jedoch ein wachsendes Problem und verringert die Wirksamkeit dieser Medikamente mit der Zeit. Fälle von Antibiotikaresistenz wurden in allen Antibiotikaklassen dokumentiert, da mikrobielle Mutationen auftreten. Der Selektionsdruck durch antimikrobielle Medikamente hat zur Zunahme resistenter Stämme beigetragen und stellt eine erhebliche Herausforderung für die globale Gesundheit dar.
Um dem drängenden Problem der Antibiotikaresistenz entgegenzuwirken, ist es unerlässlich, wirksame Infektionsschutzmaßnahmen umzusetzen, die die Ausbreitung resistenter Erreger eindämmen und gleichzeitig den Antibiotikaeinsatz reduzieren. Darüber hinaus besteht ein dringender Bedarf an alternativen Behandlungsmethoden. Die hyperbare Sauerstofftherapie (HBO) hat sich in diesem Zusammenhang als vielversprechende Methode erwiesen. Dabei wird über einen bestimmten Zeitraum 100%iger Sauerstoff unter spezifischem Druck inhaliert. Als primäre oder ergänzende Behandlungsmethode bei Infektionen eingesetzt, bietet die HBO neue Hoffnung im Kampf gegen akute Infektionen durch antibiotikaresistente Erreger.
Diese Therapie wird zunehmend als primäre oder alternative Behandlungsmethode für verschiedene Erkrankungen eingesetzt, darunter Entzündungen, Kohlenmonoxidvergiftungen, chronische Wunden, ischämische Erkrankungen und Infektionen. Die klinischen Anwendungsmöglichkeiten der hyperbaren Sauerstofftherapie (HBO) in der Infektionsbehandlung sind bedeutend und bieten Patienten unschätzbare Vorteile.

Klinische Anwendungen der hyperbaren Sauerstofftherapie bei Infektionen
Aktuelle Studien belegen eindeutig den Nutzen der hyperbaren Sauerstofftherapie (HBOT) sowohl als alleinige als auch als ergänzende Behandlung und bieten erhebliche Vorteile für infizierte Patienten. Während der HBOT kann der arterielle Sauerstoffpartialdruck auf bis zu 2000 mmHg ansteigen, und der daraus resultierende hohe Sauerstoff-Gewebe-Druckgradient kann den Sauerstoffgehalt im Gewebe auf bis zu 500 mmHg erhöhen. Diese Effekte sind besonders wertvoll für die Förderung der Heilung von Entzündungsreaktionen und mikrozirkulatorischen Störungen, die in ischämischen Umgebungen auftreten, sowie für die Behandlung des Kompartmentsyndroms.
Die hyperbare Sauerstofftherapie (HBOT) kann auch Erkrankungen beeinflussen, die vom Immunsystem abhängen. Studien deuten darauf hin, dass HBOT Autoimmunerkrankungen und antigeninduzierte Immunreaktionen unterdrücken und so zur Aufrechterhaltung der Transplantattoleranz beitragen kann, indem die Zirkulation von Lymphozyten und Leukozyten reduziert und gleichzeitig Immunreaktionen moduliert werden. Darüber hinaus kann HBOTunterstützt die HeilungBei chronischen Hautläsionen stimuliert diese Therapie die Angiogenese, einen entscheidenden Prozess für eine verbesserte Heilung. Sie fördert außerdem die Bildung einer Kollagenmatrix, eine wesentliche Phase der Wundheilung.
Besondere Aufmerksamkeit muss bestimmten Infektionen gewidmet werden, insbesondere tiefen und schwer behandelbaren Infektionen wie nekrotisierender Fasziitis, Osteomyelitis, chronischen Weichteilinfektionen und infektiöser Endokarditis. Eine der häufigsten klinischen Anwendungen der hyperbaren Sauerstofftherapie (HBO) ist die Behandlung von Haut- und Weichteilinfektionen sowie Osteomyelitis, die mit einem niedrigen Sauerstoffgehalt einhergehen und oft durch anaerobe oder resistente Bakterien verursacht werden.
1. Diabetische Fußinfektionen
Diabetischer FußUlzera sind eine häufige Komplikation bei Diabetespatienten und betreffen bis zu 25 % dieser Patientengruppe. Infektionen treten häufig in diesen Ulzera auf (in 40–80 % der Fälle) und führen zu erhöhter Morbidität und Mortalität. Diabetische Fußinfektionen (DFI) sind in der Regel polymikrobielle Infektionen, bei denen verschiedene anaerobe Bakterien nachgewiesen wurden. Verschiedene Faktoren, darunter Funktionsstörungen der Fibroblasten, Probleme der Kollagenbildung, zelluläre Immunmechanismen und die Funktion von Phagozyten, können die Wundheilung bei Diabetespatienten beeinträchtigen. Mehrere Studien haben eine verminderte Sauerstoffversorgung der Haut als starken Risikofaktor für Amputationen im Zusammenhang mit DFI identifiziert.
Als eine der aktuellen Optionen für die DFI-BehandlungEs wurde berichtet, dass die hyperbare Sauerstofftherapie (HBOT) die Heilungsrate diabetischer Fußgeschwüre signifikant verbessert und dadurch die Notwendigkeit von Amputationen und komplizierten chirurgischen Eingriffen verringert. Sie minimiert nicht nur den Bedarf an ressourcenintensiven Verfahren wie Lappenplastiken und Hauttransplantationen, sondern ist im Vergleich zu chirurgischen Optionen auch kostengünstiger und weist weniger Nebenwirkungen auf. Eine Studie von Chen et al. zeigte, dass mehr als zehn HBOT-Sitzungen zu einer Verbesserung der Wundheilungsrate um 78,3 % bei Diabetikern führten.
2. Nekrotisierende Weichteilinfektionen
Nekrotisierende Weichteilinfektionen (NSTIs) sind häufig polymikrobiell und entstehen typischerweise durch eine Kombination aerober und anaerober Bakterien. Oftmals gehen sie mit Gasbildung einher. Obwohl NSTIs relativ selten sind, weisen sie aufgrund ihres raschen Verlaufs eine hohe Mortalitätsrate auf. Eine zeitnahe und angemessene Diagnose und Behandlung sind entscheidend für einen günstigen Krankheitsverlauf. Die hyperbare Sauerstofftherapie (HBOT) wird als ergänzende Methode zur Behandlung von NSTIs empfohlen. Der Einsatz von HBOT bei NSTIs ist jedoch aufgrund fehlender prospektiver kontrollierter Studien weiterhin umstritten.Es gibt Hinweise darauf, dass es mit verbesserten Überlebensraten und Organerhalt bei NSTI-Patienten korreliert sein könnte.Eine retrospektive Studie zeigte eine signifikante Senkung der Sterblichkeitsrate bei NSTI-Patienten, die eine HBOT erhielten.
1.3 Wundinfektionen nach Operationen
Chirurgische Wundinfektionen (SSI) lassen sich anhand des Infektionsortes klassifizieren und können durch verschiedene Erreger, darunter aerobe und anaerobe Bakterien, verursacht werden. Trotz Fortschritten bei den Infektionskontrollmaßnahmen, wie Sterilisationsverfahren, dem Einsatz von prophylaktischen Antibiotika und Verbesserungen in der chirurgischen Praxis, stellen SSI weiterhin eine häufige Komplikation dar.
Eine bedeutende Studie untersuchte die Wirksamkeit der hyperbaren Sauerstofftherapie (HBOT) zur Prävention tiefer Wundinfektionen nach neuromuskulärer Skoliosechirurgie. Die präoperative HBOT kann die Häufigkeit von Wundinfektionen signifikant reduzieren und die Wundheilung fördern. Diese nicht-invasive Therapie schafft ein Milieu mit erhöhtem Sauerstoffgehalt im Wundgewebe, was mit einer oxidativen Abtötung von Krankheitserregern in Verbindung gebracht wird. Zusätzlich gleicht sie den verminderten Blut- und Sauerstoffgehalt aus, der zur Entstehung von Wundinfektionen beiträgt. Neben anderen Infektionskontrollstrategien wird die HBOT insbesondere für Eingriffe mit potenziell sauberem bis kontaminiertem Gewebe, wie beispielsweise kolorektale Operationen, empfohlen.
1.4 Brennen
Verbrennungen sind Verletzungen, die durch extreme Hitze, elektrischen Strom, Chemikalien oder Strahlung verursacht werden und mit hohen Morbiditäts- und Mortalitätsraten einhergehen können. Die hyperbare Sauerstofftherapie (HBOT) ist bei der Behandlung von Verbrennungen hilfreich, da sie den Sauerstoffgehalt im geschädigten Gewebe erhöht. Allerdings liefern Tier- und Humanstudien uneinheitliche Ergebnisse hinsichtlich der Wirksamkeit der HBOT.die Wirksamkeit der hyperbaren Sauerstofftherapie bei der Behandlung von VerbrennungenEine Studie mit 125 Brandverletzten zeigte, dass die hyperbare Sauerstofftherapie (HBOT) keinen signifikanten Einfluss auf die Sterblichkeitsrate oder die Anzahl der durchgeführten Operationen hatte, jedoch die durchschnittliche Heilungsdauer verkürzte (19,7 Tage gegenüber 43,8 Tagen). Die Integration der HBOT in ein umfassendes Brandverletztenmanagement könnte eine Sepsis bei Brandverletzten effektiv kontrollieren und so zu kürzeren Heilungszeiten und einem geringeren Flüssigkeitsbedarf führen. Um die Rolle der HBOT in der Behandlung großflächiger Verbrennungen zu bestätigen, sind jedoch weitere umfangreiche prospektive Studien erforderlich.
1.5 Osteomyelitis
Osteomyelitis ist eine Knochen- oder Knochenmarksentzündung, die häufig durch Bakterien verursacht wird. Die Behandlung kann aufgrund der relativ geringen Durchblutung der Knochen und der begrenzten Penetration von Antibiotika ins Knochenmark schwierig sein. Chronische Osteomyelitis ist durch persistierende Erreger, eine leichte Entzündung und die Bildung von Knochennekrosen gekennzeichnet. Refraktäre Osteomyelitis bezeichnet chronische Knocheninfektionen, die trotz adäquater Behandlung fortbestehen oder wiederkehren.
Die hyperbare Sauerstofftherapie (HBOT) verbessert nachweislich den Sauerstoffgehalt im infizierten Knochengewebe signifikant. Zahlreiche Fallserien und Kohortenstudien belegen, dass HBOT die klinischen Ergebnisse bei Osteomyelitis-Patienten verbessert. Die Wirkung beruht offenbar auf verschiedenen Mechanismen, darunter die Steigerung des Stoffwechsels, die Unterdrückung bakterieller Krankheitserreger, die Verstärkung der antibiotischen Wirkung, die Minimierung von Entzündungen und die Förderung der Heilung.Prozesse. Nach der HBOT zeigen 60 bis 85 % der Patienten mit chronischer, refraktärer Osteomyelitis Anzeichen einer Infektionsunterdrückung.
1.6 Pilzinfektionen
Weltweit leiden über drei Millionen Menschen an chronischen oder invasiven Pilzinfektionen, die jährlich zu über 600.000 Todesfällen führen. Die Behandlungsergebnisse bei Pilzinfektionen sind häufig durch Faktoren wie einen geschwächten Immunstatus, Grunderkrankungen und die Virulenz der Erreger beeinträchtigt. Die hyperbare Sauerstofftherapie (HBOT) entwickelt sich aufgrund ihrer Sicherheit und nicht-invasiven Natur zu einer attraktiven Therapieoption bei schweren Pilzinfektionen. Studien deuten darauf hin, dass HBOT gegen Pilzpathogene wie Aspergillus und Mycobacterium tuberculosis wirksam sein könnte.
Die hyperbare Sauerstofftherapie (HBOT) fördert die antimykotische Wirkung durch Hemmung der Biofilmbildung von Aspergillus, wobei eine erhöhte Wirksamkeit bei Stämmen ohne Superoxiddismutase-(SOD)-Gene beobachtet wurde. Die hypoxischen Bedingungen während Pilzinfektionen erschweren die Verabreichung von Antimykotika, weshalb die durch HBOT erhöhte Sauerstoffkonzentration eine potenziell vorteilhafte Intervention darstellt, obwohl weitere Forschung erforderlich ist.
Die antimikrobiellen Eigenschaften von HBOT
Die durch die hyperbare Sauerstofftherapie (HBOT) erzeugte hyperoxische Umgebung initiiert physiologische und biochemische Veränderungen, die antibakterielle Eigenschaften stimulieren und sie somit zu einer wirksamen Begleittherapie bei Infektionen machen. HBOT zeigt bemerkenswerte Wirkungen gegen aerobe und vorwiegend anaerobe Bakterien durch Mechanismen wie direkte bakterizide Aktivität, Stärkung der Immunantwort und synergistische Effekte mit spezifischen antimikrobiellen Substanzen.
2.1 Direkte antibakterielle Wirkungen der HBOT
Die direkte antibakterielle Wirkung der HBOT wird größtenteils der Erzeugung reaktiver Sauerstoffspezies (ROS) zugeschrieben, zu denen Superoxidanionen, Wasserstoffperoxid, Hydroxylradikale und Hydroxidionen gehören – die alle während des Zellstoffwechsels entstehen.
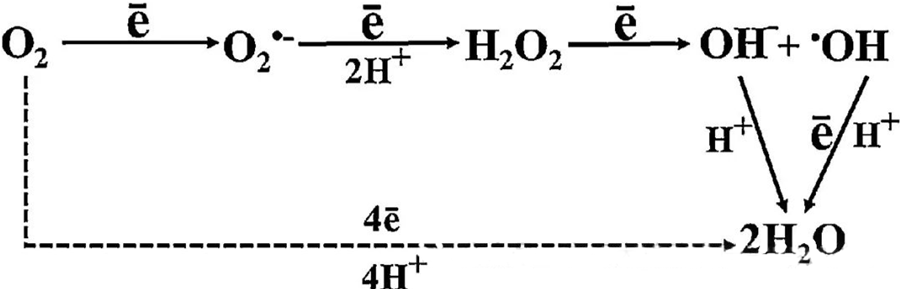
Die Wechselwirkung zwischen Sauerstoff (O₂) und zellulären Bestandteilen ist entscheidend für das Verständnis der ROS-Bildung in Zellen. Unter bestimmten Bedingungen, die als oxidativer Stress bezeichnet werden, gerät das Gleichgewicht zwischen ROS-Bildung und -Abbau aus dem Gleichgewicht, was zu erhöhten ROS-Konzentrationen in den Zellen führt. Die Bildung von Superoxid (O₂⁻) wird durch die Superoxiddismutase katalysiert, die O₂⁻ anschließend in Wasserstoffperoxid (H₂O₂) umwandelt. Diese Umwandlung wird durch die Fenton-Reaktion weiter verstärkt, welche Fe²⁺ zu Hydroxylradikalen (·OH) und Fe³⁺ oxidiert und so eine schädliche Redox-Kaskade aus ROS-Bildung und Zellschädigung in Gang setzt.
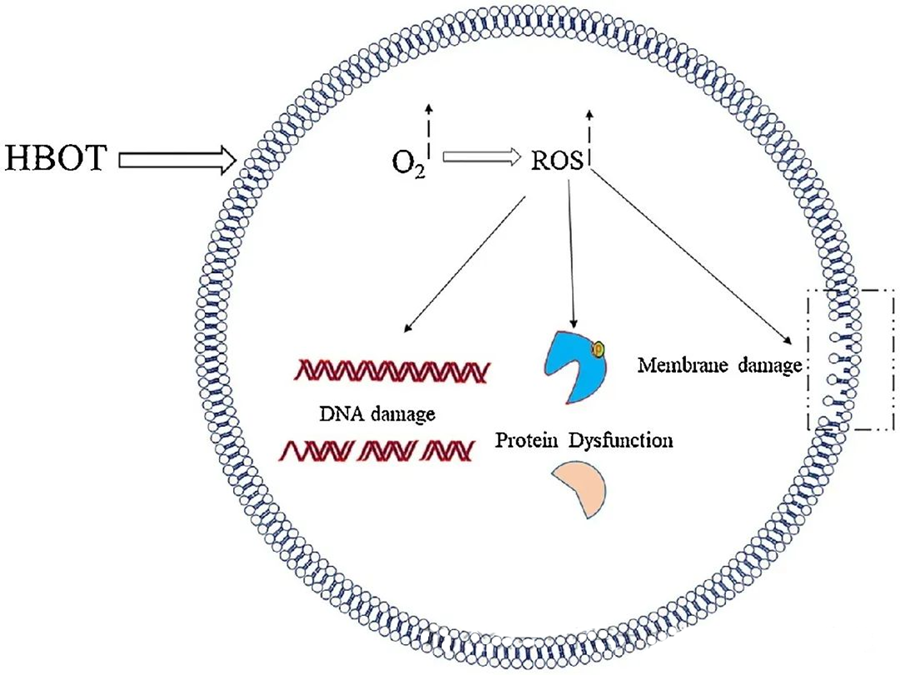
Die toxischen Wirkungen von ROS greifen wichtige Zellbestandteile wie DNA, RNA, Proteine und Lipide an. Insbesondere die DNA ist ein primäres Ziel der H₂O₂-vermittelten Zytotoxizität, da sie Desoxyribosestrukturen zerstört und die Basenzusammensetzung schädigt. Die durch ROS verursachten physikalischen Schäden erstrecken sich auch auf die Helixstruktur der DNA, möglicherweise infolge einer durch ROS ausgelösten Lipidperoxidation. Dies unterstreicht die schädlichen Folgen erhöhter ROS-Konzentrationen in biologischen Systemen.
Antimikrobielle Wirkung von ROS
Reaktive Sauerstoffspezies (ROS) spielen eine entscheidende Rolle bei der Hemmung des mikrobiellen Wachstums, wie die durch hyperbare Sauerstofftherapie (HBOT) induzierte ROS-Bildung zeigt. Die toxischen Wirkungen von ROS greifen direkt Zellbestandteile wie DNA, Proteine und Lipide an. Hohe Konzentrationen reaktiver Sauerstoffspezies können Lipide direkt schädigen und zu Lipidperoxidation führen. Dieser Prozess beeinträchtigt die Integrität der Zellmembranen und somit die Funktionalität membrangebundener Rezeptoren und Proteine.
Darüber hinaus unterliegen Proteine, die ebenfalls wichtige molekulare Zielstrukturen von ROS darstellen, spezifischen oxidativen Modifikationen an verschiedenen Aminosäureresten wie Cystein, Methionin, Tyrosin, Phenylalanin und Tryptophan. Beispielsweise induziert HBOT nachweislich oxidative Veränderungen in mehreren Proteinen von E. coli, darunter Elongationsfaktor G und DnaK, und beeinträchtigt dadurch deren zelluläre Funktionen.
Stärkung des Immunsystems durch HBOT
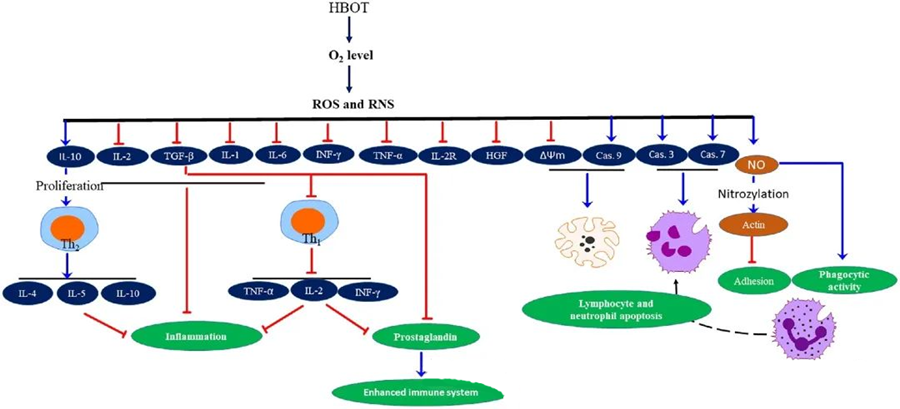
Die entzündungshemmenden Eigenschaften der HBOTEs wurde dokumentiert, dass die hyperbare Sauerstofftherapie (HBOT) entscheidend zur Linderung von Gewebeschäden und zur Unterdrückung des Infektionsverlaufs beiträgt. HBOT beeinflusst die Expression von Zytokinen und anderen Entzündungsregulatoren signifikant und wirkt sich somit auf die Immunantwort aus. Verschiedene experimentelle Systeme beobachteten unterschiedliche Veränderungen in der Genexpression und Proteinbildung nach HBOT, die Wachstumsfaktoren und Zytokine entweder hoch- oder herunterregulieren.
Während der hyperbaren Sauerstofftherapie (HBOT) lösen erhöhte O₂-Konzentrationen eine Reihe zellulärer Reaktionen aus, wie die Unterdrückung der Freisetzung entzündungsfördernder Mediatoren und die Förderung der Apoptose von Lymphozyten und Neutrophilen. Zusammengenommen verstärken diese Vorgänge die antimikrobiellen Mechanismen des Immunsystems und erleichtern so die Heilung von Infektionen.
Studien deuten zudem darauf hin, dass ein erhöhter Sauerstoffgehalt während der hyperbaren Sauerstofftherapie (HBOT) die Expression proinflammatorischer Zytokine wie Interferon-gamma (IFN-γ), Interleukin-1 (IL-1) und Interleukin-6 (IL-6) reduzieren kann. Diese Veränderungen umfassen auch eine Herabregulierung des Verhältnisses von CD4- zu CD8-T-Zellen und die Modulation anderer löslicher Rezeptoren, was letztendlich zu einem Anstieg des Interleukin-10-Spiegels (IL-10) führt. IL-10 ist entscheidend für die Bekämpfung von Entzündungen und die Förderung der Wundheilung.
Die antimikrobiellen Wirkungen der hyperbaren Sauerstofftherapie (HBOT) sind mit komplexen biologischen Mechanismen verknüpft. Sowohl Superoxid als auch erhöhter Druck fördern die HBOT-induzierte antibakterielle Aktivität und die Neutrophilenapoptose, jedoch nicht einheitlich. Nach einer HBOT führt ein deutlicher Anstieg des Sauerstoffgehalts zu einer verstärkten bakteriziden Wirkung der Neutrophilen, einem essenziellen Bestandteil der Immunantwort. Darüber hinaus hemmt HBOT die Neutrophilenadhäsion, die durch die Interaktion von β-Integrinen auf Neutrophilen mit interzellulären Adhäsionsmolekülen (ICAM) auf Endothelzellen vermittelt wird. HBOT hemmt die Aktivität des neutrophilen β-2-Integrins (Mac-1, CD11b/CD18) über einen Stickstoffmonoxid (NO)-vermittelten Prozess und trägt so zur Migration der Neutrophilen zum Infektionsort bei.
Die präzise Umstrukturierung des Zytoskeletts ist für die effektive Phagozytose von Pathogenen durch Neutrophile unerlässlich. Es wurde gezeigt, dass die S-Nitrosylierung von Aktin die Aktinpolymerisation stimuliert und dadurch möglicherweise die phagozytische Aktivität von Neutrophilen nach HBOT-Vorbehandlung steigert. Darüber hinaus induziert HBOT in humanen T-Zelllinien Apoptose über mitochondriale Signalwege, wobei ein beschleunigter Lymphozytentod nach HBOT-Behandlung beobachtet wurde. Die Blockierung von Caspase-9 – ohne Beeinträchtigung von Caspase-8 – belegt die immunmodulatorischen Effekte von HBOT.
Die synergistischen Effekte der hyperbaren Sauerstofftherapie (HBOT) in Kombination mit antimikrobiellen Wirkstoffen
In der klinischen Anwendung wird die hyperbare Sauerstofftherapie (HBOT) häufig in Kombination mit Antibiotika eingesetzt, um Infektionen effektiv zu bekämpfen. Der während der HBOT erreichte hyperoxische Zustand kann die Wirksamkeit bestimmter Antibiotika beeinflussen. Studien deuten darauf hin, dass spezifische bakterizide Medikamente wie β-Lactame, Fluorchinolone und Aminoglykoside nicht nur über körpereigene Mechanismen wirken, sondern auch teilweise auf dem aeroben Stoffwechsel von Bakterien beruhen. Daher sind die Sauerstoffverfügbarkeit und die Stoffwechseleigenschaften der Krankheitserreger entscheidend für die Beurteilung der therapeutischen Wirkung von Antibiotika.
Es gibt deutliche Hinweise darauf, dass niedrige Sauerstoffkonzentrationen die Resistenz von Pseudomonas aeruginosa gegenüber Piperacillin/Tazobactam erhöhen können und dass eine sauerstoffarme Umgebung auch zur erhöhten Resistenz von Enterobacter cloacae gegenüber Azithromycin beiträgt. Umgekehrt können bestimmte hypoxische Bedingungen die Empfindlichkeit von Bakterien gegenüber Tetracyclin-Antibiotika steigern. Die hyperbare Sauerstofftherapie (HBOT) stellt eine praktikable ergänzende Therapiemethode dar, indem sie den aeroben Stoffwechsel anregt und hypoxisch infiziertes Gewebe mit Sauerstoff versorgt, wodurch die Empfindlichkeit von Krankheitserregern gegenüber Antibiotika erhöht wird.
In präklinischen Studien reduzierte die Kombination von HBOT – zweimal täglich über 8 Stunden bei 280 kPa – mit Tobramycin (20 mg/kg/Tag) die Bakterienlast bei infektiöser Endokarditis durch Staphylococcus aureus signifikant. Dies belegt das Potenzial von HBOT als ergänzende Therapie. Weiterführende Untersuchungen zeigten, dass HBOT bei 37 °C und 3 ATA über 5 Stunden die Wirkung von Imipenem gegen Makrophagen-infizierte Pseudomonas aeruginosa deutlich verstärkte. Darüber hinaus erwies sich die Kombination von HBOT mit Cefazolin in Tiermodellen als wirksamer bei der Behandlung von Staphylococcus-aureus-Osteomyelitis als Cefazolin allein.
Die HBOT-Behandlung steigert die bakterizide Wirkung von Ciprofloxacin gegen Biofilme von Pseudomonas aeruginosa signifikant, insbesondere nach 90-minütiger Einwirkung. Diese Steigerung wird auf die Bildung endogener reaktiver Sauerstoffspezies (ROS) zurückgeführt und zeigt eine erhöhte Empfindlichkeit bei Peroxidase-defekten Mutanten.
In Modellen der durch Methicillin-resistenten Staphylococcus aureus (MRSA) verursachten Pleuritis zeigte die Kombination von Vancomycin, Teicoplanin und Linezolid mit hyperbarer Sauerstofftherapie (HBOT) eine signifikant erhöhte Wirksamkeit gegen MRSA. Metronidazol, ein häufig eingesetztes Antibiotikum zur Behandlung schwerer anaerober und polymikrobieller Infektionen wie diabetischer Fußinfektionen (DFI) und Wundinfektionen nach Operationen (SSI), wies unter anaeroben Bedingungen eine höhere antimikrobielle Wirksamkeit auf. Zukünftige Studien sind erforderlich, um die synergistischen antibakteriellen Effekte der Kombination von HBOT und Metronidazol in vivo und in vitro zu untersuchen.
Die antimikrobielle Wirksamkeit der hyperbaren Sauerstofftherapie (HBOT) gegen resistente Bakterien
Mit der Entwicklung und Verbreitung resistenter Erregerstämme verlieren herkömmliche Antibiotika häufig mit der Zeit an Wirksamkeit. Darüber hinaus kann die hyperbare Sauerstofftherapie (HBOT) bei der Behandlung und Prävention von Infektionen durch multiresistente Erreger eine entscheidende Rolle spielen und eine wichtige Strategie darstellen, wenn Antibiotikatherapien versagen. Zahlreiche Studien belegen die signifikante bakterizide Wirkung der HBOT auf klinisch relevante resistente Bakterien. Beispielsweise reduzierte eine 90-minütige HBOT-Sitzung bei 2 atm das Wachstum von MRSA deutlich. In Vergleichsstudien verstärkte die HBOT zudem die antibakterielle Wirkung verschiedener Antibiotika gegen MRSA-Infektionen. Berichte bestätigen, dass die HBOT bei der Behandlung von Osteomyelitis durch OXA-48-produzierende Klebsiella pneumoniae wirksam ist, ohne dass zusätzliche Antibiotika erforderlich sind.
Zusammenfassend lässt sich sagen, dass die hyperbare Sauerstofftherapie einen vielschichtigen Ansatz zur Infektionskontrolle darstellt, der die Immunantwort stärkt und gleichzeitig die Wirksamkeit bestehender antimikrobieller Mittel erhöht. Dank umfassender Forschung und Entwicklung birgt sie das Potenzial, die Auswirkungen von Antibiotikaresistenzen zu mindern und bietet somit Hoffnung im Kampf gegen bakterielle Infektionen.
Veröffentlichungsdatum: 28. Februar 2025

